Болезнь Паркинсона – это нейродегенеративное двигательное расстройство, которое неуклонно прогрессирует. Оно постепенно ухудшает способность человека функционировать, пока в конечном итоге он не теряет подвижность и у него часто развивается деменция. Только в США более миллиона человек страдают болезнью Паркинсона, и число новых случаев заболевания, а также общее их количество, неуклонно растут.
В настоящее время не существует методов лечения, позволяющих замедлить или остановить развитие болезни Паркинсона.
Доступные лекарства не замедляют прогрессирование заболевания и могут лечить только определенные симптомы. Однако лекарства, которые помогают на ранних стадиях заболевания, например, леводопа, с годами обычно становятся неэффективными, что требует увеличения доз, а это может привести к инвалидизирующим побочным эффектам. Без понимания фундаментальной молекулярной причины болезни Паркинсона маловероятно, что исследователи смогут разработать лекарство, способное остановить неуклонное ухудшение болезни у пациентов.
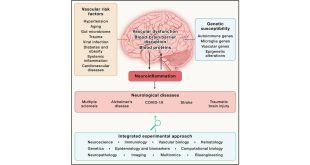
Развитию болезни Паркинсона могут способствовать многие факторы, как экологические, так и генетические. До недавнего времени генетические причины, лежащие в основе этого заболевания, были неизвестны. Большинство случаев болезни Паркинсона не передаются по наследству, а возникают спорадически, и ранние исследования предполагали, что генетическая основа маловероятна.
Тем не менее, все в биологии имеет генетическую основу. Как генетик и специалист в области молекулярной нейробиологии, профессор неврологии Университета Флориды Мэтью Фаррер посвятил свою карьеру прогнозированию и профилактике болезни Паркинсона. В недавно опубликованном исследовании его команда обнаружила новый генетический вариант, связанный с болезнью Паркинсона, который проливает свет на эволюционное происхождение множества форм семейного паркинсонизма, открывая возможности для лучшего понимания и лечения этого заболевания.
Генетические связи и ассоциации
В середине 1990-х годов исследователи начали изучать, могут ли генетические различия между людьми с болезнью Паркинсона или без нее помочь выявить специфические гены или генетические варианты, вызывающие это заболевание. В целом, генетики использует два подхода для составления генетической карты болезни Паркинсона: анализ взаимосвязей и изучение ассоциаций.
Анализ взаимосвязей фокусируется на редких семьях, в которых по наследству передается паркинсонизм или неврологические заболевания с симптомами, сходными с болезнью Паркинсона. Этот метод позволяет выявить случаи, когда вызывающая заболевание версия гена и болезнь Паркинсона, по-видимому, передаются от одного и того же человека. Для этого требуется информация о вашем генеалогическом древе, клинические данные и образцы ДНК. Для ускорения новых генетических открытий необходимо участие в исследованиях относительно небольшого количества семей с более чем двумя живыми родственниками, страдающими этим заболеванием.
“Взаимосвязь” между патогенным генетическим вариантом и развитием заболевания настолько значительна, что может помочь в постановке диагноза.
Она также стала основой многих лабораторных моделей, используемых для изучения последствий генной дисфункции и способов ее устранения. Исследования, подобные опубликованному Мэтью Фаррером его командой, выявили патогенные мутации в более чем 20 генах. Примечательно, что у многих пациентов в семьях с паркинсонизмом симптомы неотличимы от типичной болезни Паркинсона с поздним началом. Тем не менее, то, что вызывает наследственный паркинсонизм, который обычно поражает людей с более ранним началом заболевания, может и не быть причиной болезни Паркинсона у населения в целом.
И наоборот, в рамках общегеномных ассоциативных исследований, или GWAS, сравниваются генетические данные пациентов с болезнью Паркинсона и людей, не являющихся их родственниками, того же возраста, пола и этнической принадлежности, у которых нет этого заболевания. Как правило, для этого требуется оценить, насколько часто в обеих группах встречаются более 2 миллионов общих вариантов генов. Поскольку эти исследования требуют анализа очень большого количества вариантов генов, исследователям необходимо собрать клинические данные и образцы ДНК более чем у 100 000 человек.
Несмотря на то, что общегеномные ассоциативные исследования требуют больших затрат времени, они широко применимы. Объединение данных этих исследований позволило выявить множество участков в геноме, которые повышают риск развития болезни Паркинсона. В настоящее время в геноме существует более 92 участков, содержащих около 350 генов, потенциально вовлеченных в развитие этого заболевания. Однако локализации общегеномных ассоциативных исследований можно рассматривать только в совокупности; индивидуальные результаты не помогают ни в диагностике, ни в моделировании заболеваний, поскольку вклад этих отдельных генов в риск развития заболевания минимален.
В совокупности “связанные” и “ассоциативно обусловленные” открытия предполагают, что в развитии болезни Паркинсона задействован ряд молекулярных механизмов.
Каждый идентифицированный ген и белки, которые он кодирует, обычно могут иметь более одного эффекта. Функции каждого гена и белка также могут меняться в зависимости от типа клеток. Вопрос в том, какие варианты генов, их функции и пути развития наиболее значимы для развития болезни Паркинсона? Как исследователи могут обоснованно связать эти данные?
Гены болезни Паркинсона
Используя анализ взаимосвязей, Мэтью Фаррер с командой идентифицировали новую генетическую мутацию, вызывающую болезнь Паркинсона, под названием RAB32 Ser71Arg. Эта мутация была связана с паркинсонизмом в трех семьях и обнаружена еще у 13 человек в нескольких странах, включая Канаду, Францию, Германию, Италию, Польшу, Турцию, Тунис, США и Великобританию.
Хотя заболевшие люди и их семьи происходят из разных уголков мира, у них один и тот же фрагмент хромосомы 6, который содержит RAB32 Ser71Arg.
Это позволяет предположить, что все эти пациенты состоят в родстве с одним и тем же человеком; по происхождению они являются дальними родственниками.
Это также говорит о том, что у него есть еще много родственников, которых необходимо идентифицировать.
В ходе дальнейшего анализа исследователи обнаружили, что RAB32 Ser71Arg взаимодействует с несколькими белками, которые ранее связывались с ранним и поздним развитием паркинсонизма, а также с несемейной болезнью Паркинсона. Вариант RAB32 Ser71Arg также вызывает аналогичную дисфункцию в клетках.
Вместе белки, кодируемые этими связанными генами, оптимизируют уровень нейромедиатора дофамина. При болезни Паркинсона уровень дофамина снижается, поскольку клетки, которые его вырабатывают, постепенно отмирают. Вместе эти связанные гены и белки, которые они кодируют, регулируют специализированные процессы аутофагии. Кроме того, эти кодируемые белки обеспечивают иммунитет внутри клеток.
Такие взаимосвязанные гены подтверждают идею о том, что эти причины наследственного паркинсонизма возникли в процессе эволюции для улучшения выживаемости в раннем возрасте, поскольку они усиливают иммунный ответ на патогены. RAB32 Ser71Arg позволяет предположить, как и почему возникли многие мутации, несмотря на то, что они создают генетическую основу для развития болезни Паркинсона в более позднем возрасте.
RAB32 Ser71Arg – это первый выявленный исследователями связанный ген, который напрямую соединяет предыдущие открытия.
Кодируемые белки объединяют три важные функции клетки: аутофагию, иммунитет и функцию митохондрий. Хотя аутофагия высвобождает энергию, запасенную в клеточном мусоре, это должно быть скоординировано с другим специализированным компонентом клетки – митохондриями, которые являются основным поставщиком энергии. Митохондрии также помогают контролировать клеточный иммунитет, потому что они произошли от бактерий, которые иммунная система клетки распознает как “своих”, а не как вторгающийся патоген, который необходимо уничтожить.
Выявление тонких генетических различий
Поиск молекулярной модели семейной болезни Паркинсона – это первый шаг к устранению ошибочных механизмов, лежащих в основе этого заболевания. Подобно руководству по эксплуатации двигателя вашего автомобиля, оно содержит практическое руководство о том, что нужно проверить в случае неисправности двигателя.
Точно так же, как немного отличается каждая марка двигателя, у каждого человека есть свои особенности, которые делают его генетически предрасположенным к несемейной болезни Паркинсона. Однако анализ генетических данных теперь позволяет выявить типы дисфункции в клетках, которые являются признаками болезни Паркинсона. Это поможет исследователям определить факторы окружающей среды, влияющие на риск развития болезни Паркинсона, а также лекарства, которые могут помочь защититься от этого заболевания.
Чтобы найти дополнительные компоненты механизма, лежащего в основе болезни Паркинсона, необходимо участие в генетических исследованиях большего количества пациентов и семей. Геном каждого человека содержит около 27 миллионов вариантов из 6 миллиардов строительных блоков, составляющих его гены.
Существует еще много генетических компонентов, связанных с болезнью Паркинсона, которые еще предстоит обнаружить.
Как показывает открытие Мэтью Фаррера и его команды, каждый новый ген, который выявляют исследователи, может значительно улучшить нашу способность предсказывать и предотвращать болезнь Паркинсона.
Помощь психолога
 Психологическая помощь новости психологии и психотерапии
Психологическая помощь новости психологии и психотерапии